| 技術資料 |
| ■珪酸ソーダの製法 | |||||
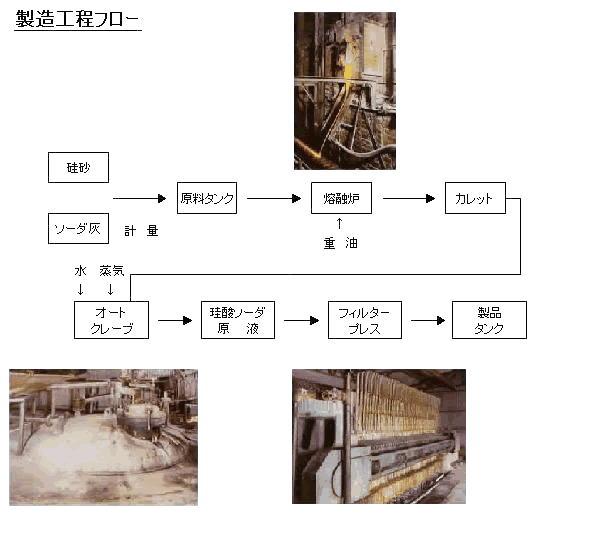
製法には、熔融法と直接法の二方法があります。 |
|||||
|
熔融法 |
|||||
|
直接法 |
|||||
 |
| ■珪酸塩の性質 | ||||||||
| a.珪酸塩無水物 | ||||||||
|
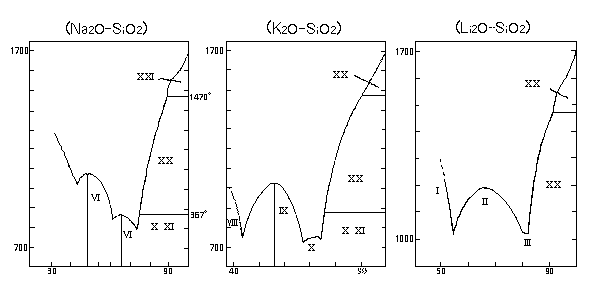
i ) 融点 |
||||||||
 |
||||||||
|
|
| ||||||
|
|
| ||||||
|
|
| ||||||
|
| |||||||
|
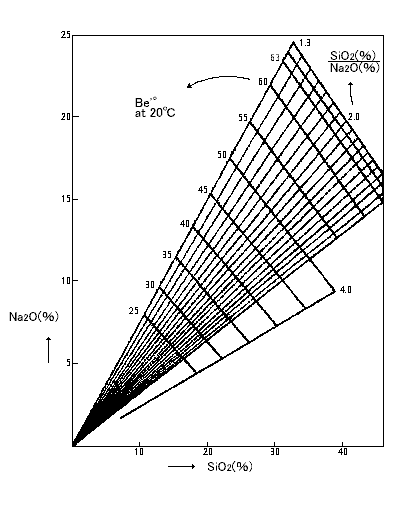
この図からオルソ珪酸塩、メタ珪酸塩、二珪酸塩、珪酸カリウム系では他にテトラ珪酸塩の結晶の存在を示しています。これらの結晶はナトリウム塩の場合モル比1.2以下の低モル比 の状態で急速に結晶化が進むのであってそれ以上のモル比ではその結晶化は非常に緩慢でありそのため現実に製造しているガラスは上記の表の様な明確な融点を示しません |
||||||||
|
珪酸ソーダ、珪酸カリのガラスの軟化点、及び流動点
|
||||
|
モル比 |
SiO2 |
M2O |
軟化点 |
流動点 |
|
珪酸ソーダ
|
||||
|
3.87
|
79.0
|
21.0
|
665
|
870
|
|
3.33
|
76.3
|
23.7
|
655
|
840
|
|
3.00
|
74.4
|
25.6
|
640
|
825
|
|
2.48
|
70.6
|
29.4
|
615
|
790
|
|
2.07
|
66.7
|
33.3
|
590
|
760
|
|
1.65
|
61.5
|
38.5
|
565
|
730
|
|
1.00
|
49.2
|
50.8
|
…
|
1089
|
|
珪酸カリ
|
||||
|
3.92
|
71.4
|
28.6
|
690-740
|
910
|
|
3.30
|
67.7
|
32.3
|
690-740
|
890
|
|
軟化点 - 粘度 4 × 10の7乗 P |
||||
| b.珪酸塩水溶液 | ||
|
i) 珪酸イオンについて |
|
各モル比に於いての珪酸ソーダ、珪酸カリの重量平均分子量
|
|||
|
珪酸ソーダ(SiO2/Na2O)
|
珪酸カリ(SiO2/K2O)
|
||
| モル比(SiO2/Na2O) | wt av moi wt in Soin | モル比(SiO2/Na2O) | wt av moi wt in Soin |
|
0.48
|
60
|
1.00
|
56
|
|
1.01
|
90
|
1.75
|
115
|
|
1.69
|
120
|
2.50
|
295
|
|
2.09
|
160
|
2.80
|
304
|
|
2.62
|
265
|
3.31
|
495
|
|
3.30
|
320
|
3.62
|
620
|
|
-
|
-
|
3.97
|
848
|
| オルソ、メタ珪酸ソーダは水中で次の様に解離していると思われます。 |
|
オルソ珪酸ソーダの場合 |
|
メタ珪酸ソーダの場合 |
|
水溶液中で配意数6のアルカリ金属のイオンの比較
|
|||||
|
Li
|
Na
|
K
|
Rb
|
Cs
|
|
| イオン半径A° |
0.60
|
0.95
|
1.33
|
1.48
|
1.69
|
| 水和イオン半径A° |
3.40
|
2.76
|
2.32
|
2.28
|
2.28
|
| hydration number |
25.3
|
16.6
|
10.5
|
|
9.9
|
| hydration energy Kcal/mol |
12.3
|
9.7
|
7.7
|
7.0
|
6.3
|
|
ii) 水素イオン濃度(pH) |
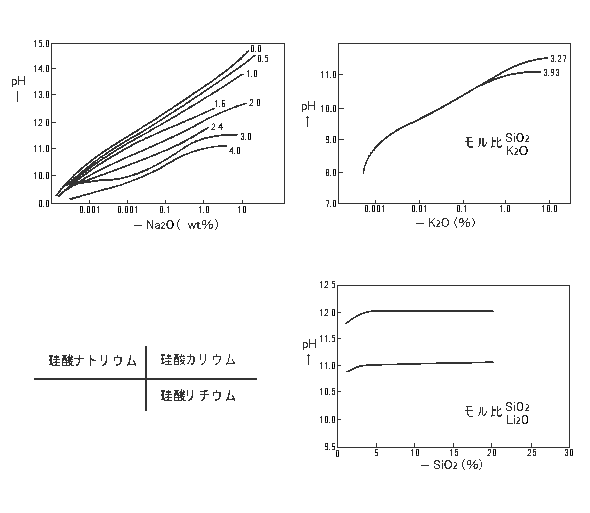 |
| 珪酸塩溶液のpHはモル比が高い程pH価は低下しますが、その緩衝能力は増加します。 |
|
iii) 粘度 |
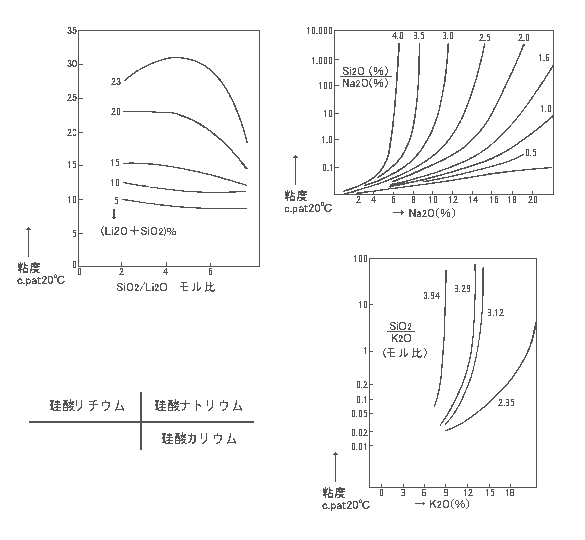 |
|
iv ) 珪酸ソーダの比重と成分の関係 |
||
|
| Na-Silicate | ||||||
|
重量比 |
モル比 |
Na2O
|
SiO2
|
d20(比重)
|
ViS |
pH
|
|
1.6
|
1.65
|
19.5
|
31.2
|
1.68
|
7,000
|
12.8
|
|
2.0
|
2.07
|
18.0
|
36.0
|
1.69
|
70,000
|
12.2
|
|
2.5
|
2.58
|
10.5
|
26.3
|
1.41
|
50
|
11.7
|
|
2.9
|
3.00
|
11.0
|
31.9
|
1.49
|
960
|
11.5
|
|
3.22
|
3.33
|
8.9
|
28.7
|
1.39
|
180
|
11.3
|
|
3.75
|
3.88
|
6.8
|
25.5
|
1.32
|
220
|
10.8
|
| K-Silicate | ||||||
|
重量比 |
モル比 |
K2O
|
SiO2
|
d20(比重)
|
ViS |
pH
|
|
2.50
|
3.92
|
8.3
|
20.8
|
1.26
|
40
|
11.30
|
|
2.20
|
3.45
|
9.05
|
19.9
|
1.26
|
7
|
11.55
|
|
2.10
|
2.30
|
12.5
|
26.3
|
1.38
|
1,050
|
11.70
|
|
1.80
|
2.83
|
16.4
|
29.5
|
1.49
|
1,300
|
12.15
|
| Li-Silicate | |||||||
|
重量比 |
モル比 |
Li2O
|
Na2O
|
SiO2
|
d20 |
ViS |
pH
|
|
9.4
|
4.7
|
2.2
|
-
|
20.7
|
1.17
|
-
|
-
|
|
9.6
|
4.8
|
2.1
|
-
|
20.0
|
-
|
40
|
11.0
|
|
11.8
|
5.9
|
1.6
|
-
|
18.8
|
1.18
|
-
|
-
|
|
17.0
|
8.5
|
1.2
|
-
|
20.0
|
-
|
25
|
11.0
|
|
Sio2/Li2O+Na2O
|
SiO2/Li2O+Na2O
|
||||||
|
6.5
|
4.1
|
1.8
|
1.2
|
19.6
|
1.19
|
-
|
10.7
|
| ■珪酸塩水溶液と他の化学薬品との反応 | |
|
①酸類 |
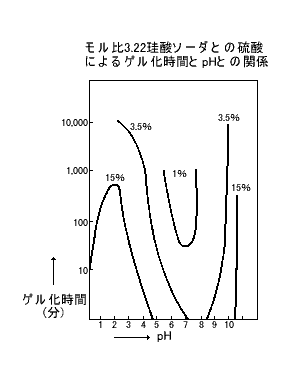 |
|
③水と混合可能な有機溶剤との反応 |
|
| ④アルミニウム、亜鉛、金属シリコン、フェロシリコン、金属水素化物例えば LiAlH4、NaBH4等の粉末は珪酸塩溶液を水に不溶化させます。 | |